Pourquoi les antiagrégants ?
Lors d’une angioplastie et dans pratiquement 90 % des cas, il est courant de se voir poser un (ou plusieurs) stents.
Le stent étant considéré comme un corps étranger, il se produit au niveau de la pose une réaction inflammatoire locale avec prolifération néo-intimale qui peut aboutir à une resténose progressive du vaisseau de l’ordre de 15 à 20 % pour les stents métalliques dits nus. Pour diminuer ces réactions, une nouvelle génération de stents (dits stents actifs) ont été proposés. Ces derniers sont enduits d’agents inhibiteurs de la prolifération endothéliale de type immunosuppresseur (sirolimus : Cypher®, éverolimus : Promus® et Xience®, zotarolimus : Endeavor®) ou cytostatique (paclitaxel : Taxus®). Avec ce type de stent le taux de resténose est descendu à 3%.
Cependant, après la dilatation et la mise en place du stent, le risque de thrombose aiguë du vaisseau avec infarctus et décès est majeur (le risque de thrombose étant majoré chez les diabétiques). Ceci nécessite donc une double thérapie AAP par aspirine et antiagrégant plaquettaire tant que le stent n’est pas recouvert d’endothélium vasculaire. Au bout de quatre à six semaines l’endothélialisation est complète pour les stents nus, l’antiagrégant peut-être alors être arrêté. En revanche, elle est beaucoup plus longue pour les stents actifs et la bithérapie AAP doit être poursuivie pendant plus longtemps, en outre pour les deux types de stents l’aspirine doit être poursuivie à vie[1].
Quels sont les principaux antiagrégants ?
Les Inhibiteurs de la cyclo-oxygénase-1
l’Acide acétylsalicylique (ou aspirine) : Le plus ancien et le plus prescrit mais surtout celui dont le rapport coût efficacité est incomparable[2].
Les inhibiteurs des récepteurs de l’adénosine diphosphate (Thiénopyridines)
- Ticlopidine (Ticlid) : Pratiquement plus utilisé dans cette indication(sauf en cas d’intolérance majeure au Clopidogrel ou au Prasugrel) du fait de ses effets indésirables hématologiques importants [3]
- Clopidogrel (Plavix) : Celui qui fut pendant longtemps le plus prescrit…
- Prasugrel (Efient) : Le Clopidogrel étant tombé dans le domaine public (et donc de ce fait génériqué), il a bien fallu trouver une « nouvelle » molécule permettant de vendre celui-ci plus cher. Voici donc l’Efient qui est commercialisé à un prix double du Plavix (et plus du double pour un Clopidogrel générique) tout en étant pas plus efficace…
Les analogues de l’adénosine triphosphate (inhibiteurs réversibles du récepteur P2Y12)
- Ticagrelor (Brilique) : Encore un nouveau produit, cette fois-ci vendu 5 fois plus cher qu’un Clopidogrel générique (et toujours pas plus efficace !)
- Cangrelor : Encore en cours de développement, injectable par voie intraveineuse
Efficacité comparée des différents antiagrégants plaquettaires :
Comparaison entre le Prasugrel (Efient) et le Clopidogrel (Plavix)
Que dit la HAS sur ce sujet ?
La décision de la HAS est sans appel : Pas d’avantage clinique démontré par rapport au Clopidogrel dans le traitement des syndromes coronariens aigus pris en charge par angioplastie coronaire percutanée
[4].
Balance bénéfice / risque ?
Un schéma étant plus parlant qu’un grand discours, voici celui tiré de l’étude TRITON-TIMI 38 :
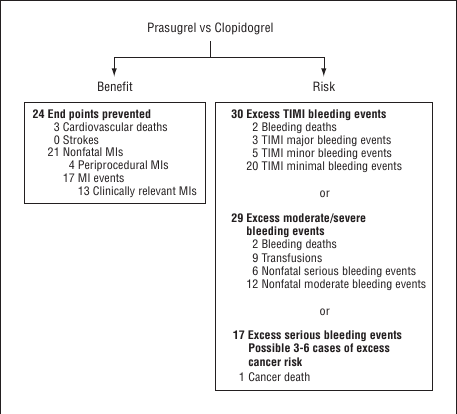
Balance bénéfice-risque dans l’essai clinique TRITON-TIMI 38 pour évaluer l’amélioration des résultats thérapeutiques avec le Prasugrel dans l’infarctus du myocarde.
Les données sont présentées pour chaque 1000 patients traités par Prasugrel au lieu du Clopidogrel.
Les données cliniquement pertinentes ont été évaluées en fonction de l’âge et de la durée de la thérapie L’infarctus du myocarde (IM) est basé sur les 3 critères de la douleur thoracique ischémique, les changements électrocardiographiques et l’élévation des biomarqueurs.
TIMI : événement hémorragique majeur: hémorragie intracrânienne symptomatique ou hémorragie cliniquement manifeste avec une chute de 5 g / dL ou plus du taux d’hémoglobine; Hémorragie mineure TIMI: saignement cliniquement manifeste avec une chute de 3 à 5 g / dL du taux d’hémoglobine; TIMI événement de saignement minimal: cliniquement hémorragie manifeste avec une baisse de moins de 3 g / dL du taux d’hémoglobine.
Et où l’on voit que les quelques améliorations sont, hélas, plus que compensées par des événements hémorragiques importants, voire mortels.
Que disent les essais cliniques ?
| Nom de l'étude | Date | Ce que l'on peut en retenir |
|---|---|---|
| Clopidogrel versus ticagrelor or prasugrel in patients aged 70 years or older with non-ST-elevation acute coronary syndrome (POPular AGE): the randomised, open-label, non-inferiority trial | 2020 | Entre le 10 juin 2013 et le 17 octobre 2018, 1002 patients ont été assignés au hasard au clopidogrel (n = 500) ou au ticagrélor ou au prasugrel (n = 502). Étant donné que 475 (95%) patients ont reçu du ticagrélor dans le groupe ticagrélor ou prasugrel, nous appellerons ce groupe le groupe ticagrélor. L'arrêt prématuré du médicament à l'étude est survenu chez 238 (47%) des 502 patients du groupe ticagrélor assignés au hasard au ticagrélor, et chez 112 (22%) des 500 patients assignés au clopidogrel au hasard. L'évolution hémorragique primaire était significativement plus faible dans le groupe clopidogrel (88 [18%] sur 500 patients) que dans le groupe ticagrélor (118 [24%] sur 502 patients) Le résultat du bénéfice clinique net coprimaire était non inférieur pour l'utilisation du clopidogrel (139 [28%]) par rapport au ticagrélor (161 [32%]) Les raisons les plus importantes d'arrêt du traitement étaient la survenue d'hémorragies (n = 38), la dyspnée (n = 40) et la nécessité d'un traitement par anticoagulation orale (n = 35) Conclusions : Chez les patients âgés de 70 ans ou plus présentant un NSTE-ACS, le clopidogrel est une alternative favorable au ticagrélor, car il entraîne moins d'événements hémorragiques sans augmentation du critère combiné de décès toutes causes, d'infarctus du myocarde, d'accident vasculaire cérébral et d'hémorragie. |
| Guided de-escalation of antiplatelet treatment in patients with acute coronary syndrome undergoing percutaneous coronary intervention (TROPICAL-ACS): a randomised, open-label, multicentre trial | 2017 | Entre le 2 décembre 2013 et le 20 mai 2016, 2610 patients ont été affectés à des groupes d'étude; 1304 au groupe de décalage guidé et 1306 au groupe témoin. Le critère d'évaluation principal a été observé chez 95 patients (7%) dans le groupe de désescalade guidé (Plavix) et chez 118 patients (9%) dans le groupe témoin (Prasugrel). Malgré la désescalade précoce, il n'y a pas eu d'augmentation du risque combiné de décès cardiovasculaire, d'infarctus du myocarde ou d'accident vasculaire cérébral dans le groupe de désalignement assigné au Plavix (32 patients [3%]) par rapport au groupe témoin assigné au Prasugrel (42 patients [3%]). Il y avait 64 événements de saignement de type BARC 2 ou supérieurs (5%) dans le groupe de Plavix par rapport à 79 événements (6%) dans le groupe Prasugrel. La désescalade guidée du traitement antiplaquettaire n'était pas inférieure au traitement standard avec Prasugrel à 1 an après la PCI en termes de bénéfices cliniques nets. Notre essai montre que la désescalade précoce du traitement antiplaquettaire peut être considérée comme une approche alternative chez les patients atteints d'un syndrome coronarien aigu administré avec une PCI. |
| A comparative evaluation of Prasugrel and Clopidogrel in patients with acute coronary syndrome undergoing percutaneous coronary intervention. | 2013 | Les patients du groupe Prasugrel ont démontré une inhibition significativement plus élevée des plaquettes par rapport au groupe Clopidogrel (82,5% vs 71,1%) à 4 heures et à 30 jours (84,1% vs 67,4%). La différence d'inhibition des plaquettes entre le Prasugrel et le Clopidogrel après la dose de charge et la dose d'entretien était statistiquement significative (p <= 0,01). Les patients ont également été évalués pour l'hyporesponsivité du médicament à la thérapie antiplaquettaire si IPA était <20% au jour 30 de la ligne de base. Plus de patients sur Prasugrel ont montré la réponse au traitement antiplatlet que sur Clopidogrel (97.4% contre 87.6%). La différence entre les deux groupes était statistiquement significative (p <0,05). Aucune différence n'a été observée au cours de l'étude sur l'incidence d'IM non mortel, d'AVC non mortel, de décès, de réhospitalisation ou de nécessité de revascularisation urgente due à un événement cardiaque entre Prasugrel et Clopidogrel. Cette étude suggère que le Prasugrel est plus efficace que le Clopidogrel en tant que médicament antiplaquettaire, comme le montre l'inhibition de l'agrégation plaquettaire. Sauf que : Aucune différence n'a été observée au cours de l'étude sur l'incidence d'IM non mortel, d'AVC non mortel, de décès, de réhospitalisation ou de nécessité de revascularisation urgente due à un événement cardiaque entre Prasugrel et Clopidogrel. |
| Prasugrel versus Clopidogrel for Acute Coronary Syndromes without Revascularization (TRILOGY ACS) | 2012 | À 30 mois, il n'y avait pas de différence significative entre les groupes dans le taux du critère d'évaluation primaire parmi la cohorte primaire de patients âgés de moins de 75 ans. Chez les patients âgés de moins de 75 ans, les courbes de Kaplan-Meier pour le critère d'évaluation primaire se chevauchaient jusqu'à environ 12 mois, après quoi les courbes divergeaient. Des observations similaires ont été faites pour chacun des points secondaires (décès dus à des causes cardiovasculaires, à tous les infarctus du myocarde et aux accidents vasculaires cérébraux). Le Prasugrel n'a pas été démontré être supérieur au Clopidogrel pour réduire le critère d'évaluation primaire pendant 2,5 ans de suivi après un événement coronarien chez les patients recevant un traitement médical sans revascularisation planifiée, bien que des signes d'inhibition intensifiée des plaquettes aient été observés dans le groupe Prasugrel. Les résultats de TRILOGY montrent des courbes de Kaplan-Meier des événements ischémiques survenues au cours du temps qui se superposent entre le groupe Prasugrel et le groupe Clopidogrel pendant un an puis qui divergent ensuite. Mais aucun critère n'atteint la significativité, à la fois dans la population générale et dans les sous-populations prédéfinies (< 65 ans, > 65 ans, > 60 kg, < 60 kg). Pris individuellement, les critères cliniques : mortalité cardiovasculaire (6,6% vs 6,8%), infarctus (8,3%vs 10,5%), AVC/AIT (1,5% vs 2,2%) et mortalité de toute cause (7,8% vs 8,11%), ne diffèrent pas non plus de façon significative. Conclusion : Chez les patients atteints d'angor instable ou d'infarctus du myocarde sans élévation du segment ST, le Prasugrel n'a pas réduit significativement la fréquence du critère d'évaluation primaire, par rapport au Clopidogrel, et des risques similaires de saignement ont été observés. |
| Prasugrel versus Clopidogrel in Patients with Acute Coronary Syndromes (TRITON–TIMI 38) | 2007 | Le taux d'efficacité primaire a été significativement réduit en faveur du Prasugrel chez les patients souffrant d'angor instable ou d'infarctus du myocarde sans élévation du segment ST (indice de risque 0,82; intervalle de confiance à 95% [IC], 0,73 à 0,93; P = 0,002 ). Des réductions significatives semblables ont été observées pour le Prasugrel dans la cohorte globale en ce qui concerne le point final secondaire pré-spécifié de décès par causes cardiovasculaires, infarctus du myocarde non fatal ou revascularisation urgente des vaisseaux cibles à 30 jours (hazard ratio, 0,78; 0,89; P <0,001) et à 90 jours (hazard ratio, 0,79; IC à 95%, 0,70 à 0,90; P <0,001). Une réduction significative du taux de revascularisation urgente du vaisseau cible seul a également été constaté dans le groupe Prasugrel d' ici la fin de la période de suivi (hazard ratio, 0,66; IC à 95%, de 0,54 à 0,81; P <0,001). Une réduction en faveur du Prasugrel a également été observée à la fin de la période de suivi pour le point final du décès par causes cardiovasculaires, infarctus du myocarde non fatal, accident vasculaire cérébral non fatal ou réhospitalisation pour ischémie (risque: 0,84; IC 95%: 0,76 0,92; P <0,001). Le taux de thrombose stent définitive ou probable, tel que défini par le Consortium de recherche académique, a été significativement réduit dans le groupe Prasugrel par rapport au groupe Clopidogrel, avec 68 patients (1,1%) et 142 patients (2,4%) respectivement, ayant au Au moins une occurrence (hazard ratio, 0,48, IC 95%, 0,36 à 0,64, P <0,001). Oui, mais : Des saignements majeurs ont été observés chez 2,4 % des patients recevant le Prasugrel et chez 1,8 % des patients sous Clopidogrel (HR = 1,32 ; IC 95 %, 1,03-1,68 ; p = 0,03). Le taux d’hémorragies engageant le pronostic vital était également plus élevé dans le groupe Prasugrel (1,4 % vs 0,9 %; p = 0,01), incluant les hémorragies mortelles (0,4 % vs 0,1 %; p = 0,002) ou non (1,1 % vs 0,9 %; HR = 1,25 ; p = 0,23). Plus de patients traités par Prasugrel (2,5%, contre 1,4% des patients traités par Clopidogrel, P <0,001) ont interrompu le traitement en raison d'événements indésirables liés à une hémorragie. Les patients ayant eu un accident vasculaire cérébral ou une attaque ischémique transitoire ont subi un préjudice net du Prasugrel (risque: 1,54, IC 95%, 1,02 à 2,32; P = 0,04), les patients âgés de 75 ans et plus n'ont pas bénéficié du Prasugrel , 0,99, IC95%, 0,81 à 1,21, P = 0,92), et les patients pesant moins de 60 kg n'ont aucun bénéfice net de Prasugrel (hazard ratio, 1,03; IC à 95%, 0,69 à 1,53; P = 0,89). Dans les deux groupes de traitement, les patients ayant au moins un de ces trois facteurs de risque avaient des taux plus élevés de saignement que ceux sans eux ( Tableau 4 Tableau 4 Le bilan de l'efficacité et de la sécurité dans certains sous-groupes. ). Les patients ayant des antécédents d'événements cérébro-vasculaires n'avaient pas de bénéfice clinique du Prasugrel (par rapport au Clopidogrel) évalué par le critère d'efficacité primaire et avaient une forte tendance à un taux plus élevé de saignements majeurs TIMI (P = 0,06) , Incluant une hémorragie intracrânienne chez six patients (2,3%) dans le groupe Prasugrel, contre aucun dans le groupe Clopidogrel (P = 0,02) Conclusions: Chez les patients présentant un syndrome coronaire aigu et relevant d’une angioplastie coronaire percutanée, le traitement par Prasugrel est associé à une réduction significative du risque d’événements ischémiques, dont les thromboses de stent, mais au prix d’une augmentation du risque de saignements majeurs, incluant des hémorragies mortelles. La mortalité globale était comparable dans les deux groupes de traitements. |
Conclusion sur l’efficacité du Prasugrel sur le Clopidogrel :
Bon, disons-le tout net : Aucun intérêt à utiliser le Prasugrel. Celui-ci est vendu plus de 3 fois le prix du Plavix pour une efficacité même pas supérieure et plus d’effets secondaires (saignements hémorragiques). Sans compter la suspicion d’augmentation des cas de cancer sous Prasugrel et dont le doute n’est toujours pas levé[5].
Comparaison entre le Ticagrelor (Brilique) et le Clopidogrel (Plavix)
Que dit la HAS sur ce sujet ?
La décision de la HAS est là aussi sans appel : Progrès thérapeutique mineur par rapport au Clopidogrel dans le syndrome coronaire aigu
[6]. Pour plus de détails, vous pouvez vous référer à l’analyse effectuée par la commission de transparence de la HAS[7].
L’avis de BIP31[8] :
Dans l’essai pivot PLATO (comparaison du ticagleror + aspirine au clopidogrel + aspirine chez 18 624 patients), les effets indésirables sont, comme désormais avec tous les nouveaux antiagrégants, la présence de plus d’hémorragies (+ 1,5 %), de plus de dyspnées (+ 6 %) mais aussi de plus de pauses cardiaques, d’hyperuricémie et d’augmentations de la créatininémie. La population incluse dans PLATO est hétérogène puisque 64 % d’entre eux ont eu une angioplastie et 10 % un pontage. Le ticagleror diminue la mortalité à 12 mois (4,5 vs 5,9 %) mais cet effet favorable ne se retrouve pas chez les patients ayant subi une angioplastie avec pose d’endoprothèse. Le ticagleror diminue également le nombre d’infarctus du myocarde symptomatiques mais pas les AVC. Surtout, il faut insister sur ses insuffisances méthodologiques avec des doutes sur le maintien du double insu et le fait que le nombre d’analyses multiples (33) laisse suggérer l’intervention du hasard. Enfin, le ticagleror et son métabolite actif sont des substrats et des inhibiteurs du cytochrome P 450 et de la glycoprotéine P : son potentiel d’interaction reste donc important. Tout ceci explique que, en janvier 2011, la commission de transparence ait attribué un SMR « insuffisant ».
Que disent les essais cliniques ?
| Nom de l'étude | Date | Ce que l'on peut en retenir |
|---|---|---|
| A prospective, multicentre, randomised, open-label trial to compare the efficacy and safety of clopidogrel versus ticagrelor in stabilised patients with acute myocardial infarction after percutaneous coronary intervention: rationale and design of the TALOS-AMI trial | 2021 | L'objectif de cet essai était d'évaluer si la désescalade de la bithérapie antiplaquettaire (DAPT) avec le clopidogrel plutôt que le ticagrelor 1 mois après une intervention coronarienne percutanée (ICP) pour un infarctus aigu du myocarde (IAM) serait une stratégie non inférieure. Une stratégie uniforme et non guidée de désescalade de la DAPT, passant du ticagrelor au clopidogrel, s’est avérée supérieure à la stratégie de poursuite de la DAPT basée sur le ticagrelor en termes de bénéfice clinique net, avec une diminution significative du risque hémorragique mais aucune augmentation du risque ischémique |
| Ticagrelor versus clopidogrel in elective percutaneous coronary intervention (ALPHEUS): a randomised, open-label, phase 3b trial | 2021 | Entre le 9 janvier 2017 et le 28 mai 2020, 1910 patients ont été répartis au hasard dans 49 sites, 956 dans le groupe ticagrélor et 954 dans le groupe clopidogrel. Le critère de jugement principal de tolérance n'a pas différé entre les deux groupes, mais des saignements mineurs ont été plus fréquemment observés avec le ticagrélor qu'avec le clopidogrel à 30 jours Conclusions : Le ticagrélor n'a pas été supérieur au clopidogrel pour réduire la nécrose myocardique périprocédurale après une ICP élective et n'a pas entraîné d'augmentation des saignements majeurs, mais a augmenté le taux de saignements mineurs à 30 jours. Ces résultats soutiennent l'utilisation du clopidogrel comme norme de soins pour l'ICP élective. |
| Clopidogrel versus ticagrelor or prasugrel in patients aged 70 years or older with non-ST-elevation acute coronary syndrome (POPular AGE): the randomised, open-label, non-inferiority trial | 2020 | Entre le 10 juin 2013 et le 17 octobre 2018, 1002 patients ont été assignés au hasard au clopidogrel (n = 500) ou au ticagrélor ou au prasugrel (n = 502). Étant donné que 475 (95%) patients ont reçu du ticagrélor dans le groupe ticagrélor ou prasugrel, nous appellerons ce groupe le groupe ticagrélor. L'arrêt prématuré du médicament à l'étude est survenu chez 238 (47%) des 502 patients du groupe ticagrélor assignés au hasard au ticagrélor, et chez 112 (22%) des 500 patients assignés au clopidogrel au hasard. L'évolution hémorragique primaire était significativement plus faible dans le groupe clopidogrel (88 [18%] sur 500 patients) que dans le groupe ticagrélor (118 [24%] sur 502 patients) Le résultat du bénéfice clinique net coprimaire était non inférieur pour l'utilisation du clopidogrel (139 [28%]) par rapport au ticagrélor (161 [32%]) Les raisons les plus importantes d'arrêt du traitement étaient la survenue d'hémorragies (n = 38), la dyspnée (n = 40) et la nécessité d'un traitement par anticoagulation orale (n = 35) Conclusions : Chez les patients âgés de 70 ans ou plus présentant un NSTE-ACS, le clopidogrel est une alternative favorable au ticagrélor, car il entraîne moins d'événements hémorragiques sans augmentation du critère combiné de décès toutes causes, d'infarctus du myocarde, d'accident vasculaire cérébral et d'hémorragie. |
| Clopidogrel or ticagrelor in acute coronary syndrome patients treated with newer-generation drug-eluting stents: CHANGE DAPT | 2017 | L'incidence de saignements majeurs était significativement plus élevée chez les patients traités par ticagrelor pendant la TP (Ticagrelor Period) Néanmoins, chez les patients atteints de SCA traités par l'ICP avec un DES de nouvelle génération, les avantages du ticagrelor dans la réduction des événements ischémiques n'a pas encore été démontrés. CHANGE DAPT confirme que le traitement par ticagrelor est associé à des saignements plus importants. Conclusions : Dans cette étude d'observation, le schéma DAPT primaire recommandé par la ligne directrice a été associé à un risque accru d'effets indésirables chez des patients atteints d'ACS et traités par PCI avec un DES de nouvelle génération. La différence concernant l'augmentation des événement indésirables est principalement attribuable au taux de saignements majeurs. L'évaluation de la non-infériorité du DAPT à base de ticagrelor pour le paramètre primaire NACCE n'a pas été concluante. |
| Ticagrelor versus Clopidogrel in Symptomatic Peripheral Artery Disease (EUCLID) | 2016 | Le critère principal d'efficacité de la mortalité cardiovasculaire, de l'infarctus du myocarde ou de l'AVC ischémique a été observé chez 751 des 6930 patients (10,8%) du groupe du ticagrelor et 740 des 6955 (10,6%) du groupe clopidogrel. La seule différence significative entre les groupes était le taux d'AVC ischémique, qui était de 1,9% dans le groupe du ticagrelor, contre 2,4% dans le groupe clopidogrel. D'autres facteurs secondaires clés et composites, y compris l'ischémie aiguë des membres et la revascularisation, étaient semblables dans les deux groupes. Les résultats globaux de l'efficacité étaient cohérents entre tous les sous-groupes, à l'exception des patients qui avaient subi une revascularisation coronarienne ou carotidienne antérieure ou un stent coronaire antérieur, chez qui une interaction favorisant le ticagrelor était observée. Le critère principal de sécurité, le saignement majeur TIMI, est survenu chez 1,6% des patients du groupe ticagrelor et du groupe clopidogrel. Les taux d'hémorragie mortelle, de saignement intracrânien et de saignement mineur TIMI étaient semblables dans les deux groupes. Il y avait moins d'événements mortels de saignement dans le groupe de ticagrelor que dans le groupe de clopidogrel (10 contre 20), mais il y avait beaucoup plus d'événements de saignement conduisant à l'arrêt avec le ticagrelor que le clopidogrel (168 contre 112). Le ticagrelor a été interrompu prématurément plus fréquemment que le clopidogrel au cours de l'étude (30,1% des patients versus 25,9%); (4,8% dans le groupe ticagrelor versus 0,8% dans le groupe clopidogrel). Dans notre étude impliquant des patients atteints d'artère périphérique, nous avons constaté que la monothérapie avec le ticagrelor n'était pas supérieure au clopidogrel dans la réduction du taux d'événements cardiovasculaires; Les taux de saignements majeurs était similaire dans les deux groupes. Il n'y avait pas non plus de différence significative entre les groupes dans le point de terminaison secondaire (ischémie aiguë des membres). Les patients recevant du ticagrelor ont interrompu le traitement plus souvent que ceux recevant du clopidogrel, principalement en raison de dyspnée et de saignements mineurs, qui sont bien décrits comme effets indésirables du médicament. |
| Ticagrelor versus Clopidogrel in Patients with Acute Coronary Syndromes (PLATO) | 2009 | Le critère de risque primaire était significativement moins fréquent dans le groupe du ticagrelor que dans le groupe du Clopidogrel ( 9,8% des patients contre 11,7% à 12 mois) En ce qui concerne les critères du seuil composite de décès par infarctus du myocarde ou AVC (10,2% vs 12,3%); L'ischémie récurrente, l'ischémie récurrente, l'attaque ischémique transitoire ou d'autres événements thrombotiques artériels (14,6% vs 16,7%), le risque de décès dû à des causes vasculaires, à un infarctus du myocarde, Infarctus du myocarde seul (5,8% contre 6,9%); Et la mortalité due à des causes vasculaires (4,0% contre 5,1%). Cette tendance s'est également traduite par une diminution du taux de mortalité de toutes les causes avec le ticagrelor (4,5% contre 5,9% pour le Clopidogrel). Le taux d'AVC ne différait pas significativement entre les deux groupes de traitement, bien qu'il y ait eu plus d'accidents hémorragiques avec le ticagrelor que le Clopidogrel (0,2% contre 0,1%). En ce qui concerne notre premier objectif secondaire de déterminer l'effet chez les patients pour lesquels un traitement invasif était planifié, le taux du critère d'évaluation primaire était également plus faible avec le ticagrelor (8,9% contre 10,6% avec le Clopidogrel). Parmi les patients qui ont reçu un stent au cours de l'étude, le taux de thrombose définie du stent était plus faible dans le groupe du ticagrelor que dans le groupe du Clopidogrel (1,3% contre 1,9%). Le bénéfice du ticagrelor semble être atténué chez les patients pesant moins que le poids médian pour leur sexe, ceux qui ne prennent pas de médicaments hypolipidémiants à la randomisation (NDLR : donc statines obligatoires ?) et ceux qui sont inscrits Amérique du Nord. Cependant, dans le groupe du ticagrelor, il y avait un taux plus élevé de saignements majeurs non liés à la coronaropathie selon les critères de l'étude (4,5% contre 3,8%) et les critères TIMI (2,8% contre 2,2% ). Avec le ticagrelor par rapport au Clopidogrel, il y avait plus d'épisodes de saignements intracrâniens (26 vs 14 ), y compris des saignements intracrâniens mortels (0,1% contre 0,01% NDLR : 10 fois plus quand même...). Cependant, il y avait moins d' épisodes d'autres types de saignements mortels dans le groupe ticagrelor (0,1%, contre 0,3% dans le groupe Clopidogrel). La dyspnée était plus fréquente dans le groupe ticagrelor que dans le groupe Clopidogrel (13,8% des patients contre 7,8%). En conclusion, je reprendrais celle de la HAS Progrès thérapeutique mineur par rapport au Clopidogrel dans le syndrome coronaire aigu |
| Nom de l'étude | Date | Ce que l'on peut en retenir |
|---|---|---|
| Ticagrelor or Prasugrel for Patients With Acute Coronary Syndrome Treated With Percutaneous Coronary Intervention | 2021 | Le critère d'évaluation principal s'est produit pour 162 patients (9,8 %) dans le groupe ticagrelor et 120 patients (7,1 %) dans le groupe prasugrel Un infarctus du myocarde est survenu chez 88 patients (5,3 %) dans le groupe ticagrelor par rapport à 55 patients (3,8 %) dans le groupe prasugrel Le critère d'évaluation de la sécurité, l'hémorragie BARC de type 3 à 5, est survenue chez 84 des 1672 patients (5,3 %) du groupe ticagrelor et 78 des 1680 patients (4,9 %) du groupe prasugrel Parmi les patients présentant un SCA qui ont été traités par ICP, l'incidence du critère d'évaluation principal composite s'est produite moins fréquemment chez les patients ayant reçu du prasugrel que ceux ayant reçu du ticagrelor |
| Prasugrel versus Ticagrelor in Patients with Acute Myocardial Infarction Treated with Primary Percutaneous Coronary Intervention (PRAGUE-18) | 2016 | L'étude a été terminée prématurément pour futilité. L'occurrence du critère d'évaluation primaire ne diffère pas entre les groupes recevant prasugrel et ticagrelor (4,0% et 4,1% respectivement). Aucune différence significative n'a été trouvée dans aucune des composantes du critère d'évaluation primaire. L'apparition d'un point secondaire clé dans les 30 jours, composée de décès cardiovasculaire, d'IM non mortel ou d'accident vasculaire cérébral, n'a pas montré de différence significative entre prasugrel et ticagrelor (2,7% et 2,5%). Conclusion: Cette comparaison directe du prasugrel et du ticagrelor ne soutient pas l'hypothèse que l'un est plus efficace ou plus sûr que l'autre dans la prévention des événements ischémiques et hémorragiques dans la phase aiguë de l'infarctus du myocarde traitée avec la stratégie de PCI primaire. Les taux observés de résultats majeurs étaient semblables, bien qu'avec de larges intervalles de confiance autour des estimations. Ces observations intéressantes doivent être confirmées dans un essai de plus longue durée. |
Conclusion sur l’efficacité du Tigracelor par rapport au Clopidogrel / Prasugrel :
Une fois de plus, un produit récent ne fait même pas mieux que son prédécesseur vendu 5 fois moins cher…
Conclusion sur les nouveaux antiagrégants plaquettaires (Prasugrel et Tigracelor) :
Que se soit le Prasugrel ou encore le Brilique, ces deux produits ne se sont même pas montrés plus efficace que le Clopidogrel, surtout aves les DES (stents) de dernière génération. Pas plus d’efficacité et une dangerosité supérieure due aux saignements hémoragiques.
Ce qui ne va pas empêcher les cardiologues (qui ne doivent pas lire les essais cliniques…) de se jeter sur ces produits commercialisés beaucoup plus cher (jusqu’à 5 fois plus cher pour le Tigracelor) pour une efficacité même pas supérieure et bien sûr remboursés intégralement par la sécu…
Nos abrutis de ministres de la santé successifs seraient bien avisés d’en interdire le remboursement, ou tout au moins d’en limiter celui-ci au prix du générique de même efficacité. Hélas, vu le niveau d’incompétence (ou de compromission…) de ces derniers, ce n’est pas prêt de voir le jour !
Et puis que voulez-vous, il faut bien que les labos pharmaceutiques fassent encore et toujours de plus gros profits…
Quelle durée optimum de traitement par antiagrégants plaquettaires ?
Que dit la HAS ?
La HAS (Haute Autorité de Santé), dans son guide « Maladie Coronarienne Stable » recommande les durées de traitement suivantes[9] :
- Après angioplastie au ballon hors contexte d’infarctus du myocarde : association aspirine (75-160 mg/j) + Clopidogrel (75 mg/j) pendant 1 mois
- Après pose de stent nu hors contexte d’infarctus : association aspirine (75-160 mg/j) + Clopidogrel (75 mg/j) pendant 1 mois
- Après pose de stent actif : association aspirine (75-160 mg/j) + Clopidogrel (75 mg/j) pendant 6 à 12 mois
Que disent les essais cliniques ?
J’ai fait figurer dans le tableau ci-dessous indifféremment les essais cliniques ainsi que les méta-analyses évaluant les avantages et inconvénients d’une durée de traitement longue (en général >1 an) par rapport à une durée courte (3, 6 mois et 1 an).
Tous sont unanimes : aucun intérêt à prolonger la bithérapie par antiagrégants plaquettaires sur une longue durée, la durée optimum se situant entre 3 et 12 mois avec aucune différence entre ces durées, que ce soit pour la mortalité toutes causes, cardiovasculaire, les thromboses de stent, les AVC, etc..
Antiagrégants plaquettaires et durée de traitement
| Nom de l'étude | Date | But de l'étude | Ce que l'on peut en retenir | Conclusions |
|---|---|---|---|---|
| Six Versus Twelve Months of Dual Antiplatelet Therapy After Drug-Eluting Stent Implantation in ST-Elevation Myocardial Infarction - DAPT-STEMI | 2017 | L'objectif de l'étude était d'évaluer l'innocuité et l'efficacité d'un traitement antiplaquettaire double (TAPD) de 6 mois par rapport à 12 mois chez des patients présentant un infarctus du myocarde à segment ST élévé (STEMI) et subissant une intervention coronarienne percutanée primaire (PPCI) avec endoprothèse de deuxième génération à élution médicamenteuse (DES). | Le résultat principal, mortalité toutes causes confondues, IM, revascularisation, accident vasculaire cérébral et hémorragie majeure due à l'IIMT à 18 mois pour le DAPT de 6 mois contre 12 mois, était de 4,8 % contre 6,6 %, p pour la non-infériorité = 0,004, p pour la supériorité = 0,26. Mortalité toutes causes confondues: 0,7 % contre 1,4 %, IM: 1,8 % vs 1,8 %, Saignement majeur TIMI: 0,2% vs. 0,5%, Thrombose de l'endoprothèse: 0,7 % vs 0,9 %, Échec de la lésion cible: 1,2% vs 1,8%, | Les résultats de cette étude indiquent que chez les patients qui sont demeurés exempts d'événements indésirables à 6 mois après l'administration de PPCI avec ZES pour STEMI, l'arrêt du DAPT après 6 mois par rapport à un arrêt de 6 mois après l'implantation de l'endoprothèse (12 mois au total) n'est pas inférieur aux résultats cliniques après 2 ans. |
| Duration of Dual Antiplatelet Therapy: A Systematic Review for the 2016 ACC/AHA Guideline Focused Update on Duration of Dual Antiplatelet Therapy in Patients With Coronary Artery Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. | 2016 | Notre objectif était de comparer l'incidence de décès, d'hémorragie majeure, d'infarctus du myocarde, de thrombose de stent et d'événements cardiaques indésirables majeurs chez des patients randomisés en DAPT de longue durée ou de courte durée après implantation de DES de nouvelle génération et en prévention secondaire après MI | L'utilisation de DAPT pendant 12 mois, par rapport à l'utilisation pendant 3 à 6 mois, n'a entraîné aucune différence significative (IC: 0,85 à 1,63), d’hémorragie majeure (OR: 1,65; IC 95%: 0,97 à 2,82), MI (OR: 0,87; IC 95% IC: 0,65 à 1,18) ou thrombose de stent (OR: 0,87; IC 95%: 0,49 à 1,55). L'utilisation de DAPT pendant 18 à 48 mois, comparée à l'utilisation pendant 6 à 12 mois, était associée à une augmentation de l'incidence de décès toutes causes (OR: 1,14; IC à 95%: 0,92 à 1,42) Une diminution des MI (OR: 0,67; IC 95%: 0,47 à 0,95) et une diminution de la thrombose des stents (OR: 0,45; IC 95%: 0,24 à 0,74). Une analyse risque-bénéfice a révélé que 3 fois moins de thromboses de l'endoprothèse (IC à 95%: 2 à 5) et 6 fois moins d'IC (IC 95%: 2 à 11) mais 5 fois plus de saignements majeurs (IC 95%: 3 à 9) avec une durée de traitement par DAPT prolongé pendant un an. Les analyses post hoc ont fourni des preuves faibles de l'augmentation de la mortalité avec le DAPT prolongé. L'utilisation de DAPT> 1 an après l'IM a réduit le risque composite de décès cardiovasculaire, Ratio: 0,84; IC 95%: 0,74 à 0,95), mais a provoqué une hausse des hémorragies majeures (hazard ratio: 2,32; IC 95%: 1,68 à 3,21). | L'analyse primaire fournit des preuves modérées qu’une thérapie prolongée de DAPT après implantation de DES de nouvelle génération implique un compromis entre la réduction de la thrombose des stents et MI et l'augmentation des hémorragies majeures. Les analyses secondaires fournissent des preuves faibles d’une augmentation de la mortalité avec une thérapie par DAPT prolongé après implantation d’un DES. Chez les patients dont le risque de thrombose coronaire était défini par un LI antérieur plutôt que par une implantation du DES, l'analyse primaire fournit des preuves modérées de la réduction des événements cardiovasculaires aux dépens d'une augmentation des saignements. |
| The optimal duration of dual antiplatelet therapy in patients receiving percutaneous coronary intervention with drug-eluting stents. | 2016 | Nous avons recherché dans les bases de données MEDLINE, EMBASE, Scopus et CENTRAL des essais contrôlés randomisés (ECA) admissibles qui comparaient le DAPT à court terme (6 mois) avec le DAPT à long terme (≥ 12 mois) après l'implantation du DES. Le critère d'évaluation principal était un ensemble de mortalité toutes causes confondues, infarctus du myocarde (IM), revascularisation des vaisseaux cibles (TVR), accident vasculaire cérébral ou saignements majeurs. Le résultat secondaire était les composantes individuelles du résultat primaire, de la mortalité cardiovasculaire, de la thrombose du stent et de tout épisode de saignement. | Il n'y avait pas de différence dans les résultats d'efficacité entre DAPT à court terme et à long terme après DES, même chez les patients à haut risque. Cependant, une plus longue durée de DAPT s'est avérée associée à un risque accru de saignements majeurs. Il n'y a pas eu de différence statistiquement significative entre les groupes DAPT à court terme et à long terme en ce qui concerne l'apparition du résultat primaire provoquant un décès (rapport de risque: 1,017; 0,872-1,186; I2 = 0%), La mortalité cardiovasculaire (RR 0,924; 0,668-1,279), MI (RR 1,139; 0,887-1,461), TVR (RR 1,174; 0,916-1,505), la thrombose de stent (RR 1,264; 0,786-2,032) et les accidents vasculaires cérébraux (RR 0,876; 0,685-1,611). Cependant, il existait un risque statistiquement plus faible de saignement majeur dans le groupe DAPT à court terme (RR 0,57; 0,36-0,90; p = 0,02). Il n'y avait aucune différence statistiquement significative dans l'analyse du sous-groupe de patients diabétiques et de patients présentant un syndrome coronarien aigu (RR 1,029; 0,745-1,421 et RR 1,062; 0,785-1,438, respectivement). Critère d'évaluation primaire : Le critère principal est survenu chez 309 patients (4,0%) ayant reçu un DAPT à court terme et chez 305 (4,0%) patients ayant reçu un DAPT à long terme. Il n'y avait pas de différence statistiquement significative entre les groupes DAPT à court et à long terme en ce qui concerne la survenue du résultat primaire. Critères d'évaluation secondaires : Aucune différence statistiquement significative n'a été observée entre le risque de mortalité toutes causes (pRR 0,90, 0,71-1,13, I2 = 0%), la mortalité cardiovasculaire (pRR 0,92, 0,67-1,28, I2 = 0% 1,14; 0,89-1,46; I2 = 0%), thrombose de stent (pRR 1,264; 0,79-2,03; I2 = 0%), TVR (pRR 1,17; 0,91-1,51; I2 = 0%) et accidents vasculaires cérébraux (pRR 0,88; 0,69-1,61; I 2 = 0%), entre durée courte et longue de traitement par DAPT. Cependant, des saignements importants sont survenus chez 28 (0,4%) à court terme DAPT groupe et dans 51 (0,7%) patients qui ont reçu à long terme DAPT. Il y avait un risque beaucoup plus faible de saignements majeurs dans le groupe de traitement DAPT à court terme par rapport au groupe DAPT à long terme (pRR 0,57, 0,36-0,90, I 2 = 0%, p = 0,02). | Il n'y avait pas de différence dans les résultats d'efficacité entre DAPT à court terme et à long terme après DES, même chez les patients à haut risque. Cependant, une plus longue durée de DAPT s'est avérée associée à un risque accru de saignements majeurs. |
| Dual Antiplatelet Therapy Duration: A Review of Current Available Evidence. | 2016 | Nous avons cherché à identifier différents essais cliniques randomisés (ECR), analyses groupées, méta-analyses et données relatives à la durée optimale du DAPT et tenter certaines recommandations basées sur les profils cliniques et de procédure des patients. Nous avons effectué une recherche exhaustive à l'aide des sources MEDLINE, Scopus, Cochrane Library et Internet pour des résumés, des manuscrits et des rapports de conférence sans aucune restriction de langue ou de date. | Il n'existe aucune preuve concluante qui détermine la durée de DAPT obligatoire après PCI. En outre, il existe des populations de patients distinctes qui ont besoin de régimes de traitement spécifiques, tels que les patients diabétiques ou ceux sous anticoagulants oraux à long terme. Par conséquent, le jugement clinique et l'examen méticuleux de tous les facteurs de risque pertinents sont requis pour chaque individu. Ces facteurs comprennent ceux liés aux caractéristiques d'un patient, aux procédures de traitement, à la complexité des lésions et au type de stent. | |
| Duration of Dual Antiplatelet Therapy: A Systematic Review for the 2016 ACC/AHA Guideline Focused Update on Duration of Dual Antiplatelet Therapy in Patients With Coronary Artery Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines | 2016 | Meta-analyse des études suivantes : DES LATE, PRODIGY, EXCELLENT, RESET, OPTIMIZE, ARTIC Interruption, SECURITY, ITALIC, ISAR-SAFE, DAPT et OPTIDUAL | Les 11 essais randomisés ont permis d’inclure 33 051 patients répondants aux critères d’inclusion. Tout d’abord, la prescription d’une DAP pendant 12 mois vs 3 à 6 mois n’a pas montré de différence significative sur l’incidence de décès (OR 1.17; IC 95% 0.85-1.63), de saignement majeur (OR 1.65; IC 95% 0.97-2.82), d’IDM (OR 0.87; IC 95% 0.65-1.18), et de thrombose de stent (OR 0.87; IC 95% 0.49-1.55). Le modèle Bayesien confirme ces analyses primaires. La poursuite de DAP de 18 à 48 mois vs 6 à 12 mois ne montrait pas de différence significative sur la mortalité toute cause (OR 1.14; IC 95% 0.92-1.42) mais était associée à une majoration des saignements majeurs (OR 1.58; IC 95% 1.20-2.09) et à une diminution des IDM (OR 0.67; IC 95% 0.47-0.95) et des thromboses de stent (OR 0.45; IC 95% 0.24-0.74). Seules deux autres études, un essai randomisé (PEGASUS-TIMI 54) et une sous-analyse post-hoc (CHARISMA) apportaient des éléments de réponse sur l’effet clinique d’une DAP chez des patients stables plus d’un an après leur IDM. Selon ces deux études, la prescription de DAP au-delà d’un an après l’IDM, réduisait le risque composite de décès cardiovasculaires, IDM et AVC (HR 0.84; IC 95% 0.74-0.95) mais augmentait les saignements majeurs (HR 2.32; IC 95% 1.68-3.21). Cependant, la population était, dans ces deux études, à haut risque thrombotique, soit la population qui peut tirer le plus de bénéfice d’une DAP au long cours. | Les essais cliniques randomisés suggèrent que les patients avec des stents actifs de dernière génération, plus sûrs, peuvent être traités avec une durée de DAP minimum de 3 à 6 mois. |
| Meta-Analysis of the Duration of Dual Antiplatelet Therapy in Patients Treated With Second-Generation Drug-Eluting Stents | 2016 | Le travail a été mené de novembre 2014 à avril 2015. Tous les essais contrôlés randomisés comparant une traitement par DAPT de courte durée (<12 mois) versus longue durée (≥ 12 mois) chez des patients traités avec DES de deuxième génération ont été analysés. Huit essais randomisés contrôlés avec 18 810 patients randomisés ont été inclus. Les études ont comparé une durée de DAPT de 3 mois contre 12 mois (2 essais), 6 mois contre 12 mois (3 essais), 6 mois contre 24 mois (1 essai), 12 mois contre 24 mois (1 essai) et 12 mois contre 30 mois (1 essai). | Entre une durée courte et longue de DAPT , il n'y avait pas de différences significatives pour les décès de toutes les causes (odds ratio [OR] 0,87; intervalle de confiance à 95% [0,66 à 1,44]), décès cardiovasculaire (OR 0,95; IC 95%: 0,65 à 1,37) et ST (stent thrombosis) (OR 1,20; IC à 95%: 0,79 à 1,83), et aucune différence n'était présente lorsque l'on considérait séparément les stents à élution d'everolimus et à libération rapide de zotarolimus. Une durée de DAPT plus courte était inférieure à une durée plus longue dans la prévention du MI (OR 1,35; IC à 95%: 1,03 à 1,77). À l'inverse, les saignements majeurs ont été réduits par une DAPT plus courte (OR 0,60; IC à 95%: 0,42 à 0,96). Les caractéristiques de base n'ont pas influencé ces résultats dans l'analyse de méta-régression. | Une durée de DAPT pour ≤6 mois est raisonnable chez les patients traités avec des stents à élution d'everolimus et à libération rapide de zotarolimus, avec le bénéfice d'un saignement moins important au coût de l'augmentation de l'IM, avec des taux de survie et ST similaires. Une approche individualisée de la durée du DAPT par le patient devrait prendre en compte les risques concurrents de saignement et de complications ischémiques après le DES de la présente génération. |
| Shorter (≤6 months) versus longer (≥12 months) duration dual antiplatelet therapy after drug eluting stents: a meta-analysis of randomized clinical trials. | 2015 | La durée optimale de la thérapie antiplaquettaire double (DAPT), définie comme l'utilisation à la fois de l'aspirine et d'un inhibiteur du récepteur P2Y12, après implantation de stents à élution médicamenteuse (DES), fait toujours l'objet de discussions. Nous avons examiné systématiquement l'efficacité et la sécurité d’une durée de traitement par DAPT de ≤6 mois versus ≥12 mois après implantation de DES. Les bases de données PubMed, Scopus, Cochrane et clinicaltrials.gov ont été recherchées pour les études publiées jusqu'au 30 novembre 2013. Les études étaient limitées aux essais cliniques randomisés. | L'inhibiteur du récepteur P2Y12 utilisé dans les quatre études était le Clopidogrel. La durée plus longue du DAPT n'a pas réduit le risque de mortalité toutes causes confondues (OR combiné 0,89, IC 95% 0,67-1,17, P = 0,4, I (2) = 0%), infarctus du myocarde (RR combiné 1,16, IC 95% 0,85-1,57 (IC de 95%: 0,61-1,25, P = 0,47, I (2) = 0%), thrombose du stent (EC combiné de 1,29, IC à 95% 0,76-2,21, P = 0,35, I (2) = 0%) ou accidents vasculaires cérébraux (OR combiné 0,73, IC 95% 0,41-1,27, P = 0,26, I (2) = 0%). La durée plus longue du DAPT a été associée à un risque accru de saignement majeur TIMI (OR combiné 0.51, IC à 95% 0.29-0.89, P = 0.02, I (2) = 0%). | Il n'y avait pas de différence dans les résultats d'efficacité entre une durée de DAPT ≤6 mois de ≥12 mois chez les patients atteints de maladie cardiovasculaire et après implantation de DES. De plus, une plus longue durée de DAPT est associée à un risque accru de complications hémorragiques. |
| Short- Versus Long-Term Duration of Dual-Antiplatelet Therapy After Coronary Stenting | 2015 | Nous avons évalué l’impact de 6 jusqu'à 24 mois de thérapie antiplaquettaires double dans une population de patients sous Clopidogrel + aspirine | L’estimation de Kaplan-Meier de la fréquence d’événement pour le point de terminaison principal (décès toute cause, infarctus du myocarde ou accident vasculaire cérébral) à 2 ans était de 10,1 % dans le groupe Clopidogrel 24 mois comparé à 10,0 % dans le groupe Clopidogrel 6 mois. Il n’y avait pas de différence significative entre les 2 groupes concernant le risque pour le points de terminaison secondaires (décès toute cause, mort de causes cardio-vasculaires, infarctus du myocarde, accident vasculaire cérébral ou thrombose de stent. Parmi les patients assignés à recevoir la thérapie à long terme comparée à ceux désignés pour recevoir à la thérapie à court terme, il y avait une environ 2 fois plus de risque de type 5, 3 ou 2 (risque relatif, 2.17 ; 95 % CI, de 1,44 – 3.22 ; P= 0,00018 ) et de saignements de type 5 ou 3 événements (risque relatif, 1,78 ; 95 % CI, de 1,02 – 3.13 ; P= 0,037) selon la classification de la « Bleeding Academic Research Consortium classification ». Les risques hémorragiques définie par TIMI ainsi que ceux des transfusions ont également augmentés dans le groupe Clopidogrel 24 mois. L’incidence du point de terminaison composite primaire de 6 à 24 mois était de 7,2 % (69 patients) à long terme et 6,5 % (62 patients) dans le groupe recevant du Clopidogrel à court terme (risque relatif, 0,89 ; 95 % CI, de 0,64 – 1,25 ; P= 0,53). Chez les patients qui ont été répartis au hasard au groupe DES (drug-eluting stent) lors de l’angioplastie, les décès toute cause, infarctus du myocarde ou accident vasculaire cérébral pour une durée de 6 à 24 mois ont eu lieu chez 49 patients (6,8 %) dans le groupe de 24 mois et 43 (6,0 %) dans le groupe 6 mois (risque relatif, 0,87 ; 95 % CI, de 0,58 – 1.31 ; P= 0,51). Enfin, dans ce sous-groupe de patients traités par DES, la mortalité toutes causes (4,4 % contre 4,0 % ; P= 0,81), le composite de décès toutes causes ou MI (6,0 % contre 5,7 % ; P= 0,92) et l’incidence de thrombose de stent définitive (0,42 % contre 0,56 % ; P> 0.99) ne différait pas à partir 6 mois dans le groupe 24 mois contre les groupes de traitement de 6 mois. | Un traitement de 24 mois de traitement au Clopidogrel chez les patients ayant reçu un mélange équilibré de stents à élution de médicament (actifs) ou de stents en métal nu (stents passifs) n’était pas significativement plus efficace qu’un régime de 6 mois de traitement au Clopidogrel dans le réduction de l’ensemble des décès toute cause, par infarctus du myocarde ou accident vasculaire cérébral. |
| Optimal duration of dual antiplatelet therapy after percutaneous coronary intervention with drug eluting stents: meta-analysis of randomised controlled trials | 2015 | Les termes de recherche selon les thèmes médicaux étaient les suivants : “DAPT”, “dual antiplatelet therapy”, “Clopidogrel”, “Plavix”, “Prasugrel”, “Efient”, “ticagrelor”, “Brilinta”, “thienopyridine”, “P2Y12”, “shortened DAPT”, “prolonged DAPT”, “extended DAPT”, “premature cessation”, “early discontinuation”, “randomised trial”, et “trial”. | 10 essais randomisés contrôlés (n = 32 287) ont été inclus. Comparé au traitement de 12 mois, un traitement à court terme a été associé à une réduction significative des saignements majeurs (odds ratio de 0,58 (intervalle de confiance de 95%: 0,36 à 0,92), p = 0,02) sans différence significative dans les résultats ischémiques ou thrombotiques. Le traitement par DAPT prolongé par rapport à 12 mois a permis une réduction significative de la probabilité d'infarctus du myocarde (0,53 (0,42 à 0,66), P <0,001) et de thrombose de l'endoprothèse (0,33 à 0,21) 1,26 à 2,09), P <0,001). Toutes les causes mais non les décès cardiovasculaires ont également été significativement augmentées (1,30 (1,02 à 1,66), P = 0,03). | Par rapport à une durée standard de 12 mois, la DAPT à court terme (<12 mois) après la mise en place d'un stent à élution médicamenteuse réduit le saignement sans augmentation apparente de complications ischémiques et pourrait être envisagée pour la plupart des patients. Chez certains patients présentant un faible risque de saignement et un risque ischémique très élevé, une DAPT étendue (> 12 mois) pourrait être envisagée. L'augmentation de toutes les causes sans décès cardiovasculaire avec DAPT étendu nécessite une étude plus poussée. |
| Duration of Dual Antiplatelet Therapy After Drug-Eluting Stent Implantation - A Systematic Review and Meta-Analysis of Randomized Controlled Trials | 2015 | Meta-analyse des études suivantes : RESET, OPTIMIZE, ISAR-SAFE, ITALIC, SECURITY, EXCELLENT, PRODIGY, DAPT, DES-LATE and ARCTIC-Interruption | Une thérapie de courte durée était associée à des taux de thrombose de stent nettement ou plus vraisemblablement plus élevés comparés à une thérapie longue. La magnitude de l'effet d’une thérapie de courte durée sur la thrombose de l'endoprothèse vasculaire a été significativement atténué avec l'utilisation des DES de deuxième génération. Cependant, le bénéfice thrombotique d’une thérapie de longue durée a été corrélée à un risque plus élevé de saignement et de mortalité toutes causes confondues. Les résultats de la présente méta-analyse indiquent que le rapport risque / bénéfice entre l'arrêt ou la poursuite du DAPT après une période initialement recommandée doit être soigneusement individualisé compte tenu du compromis entre risque ischémique et risque futur de saignement. | La thérapie de courte durée présentait des taux globaux plus faibles de saignement, mais des taux plus élevés de thrombose de l'endoprothèse que la thérapie de longue durée; Ce dernier effet a été significativement atténué avec l'utilisation de DES de deuxième génération, bien que l'analyse ait pu être limitée par les durées variables de DAPT parmi les études. La mortalité toutes causes a été numériquement plus élevée avec thérapie de longue durée sans atteindre une signification statistique. La prolongation du DAPT exige une évaluation minutieuse du compromis entre les complications ischémiques et les complications hémorragiques. |
| Dual-antiplatelet treatment beyond 1 year after drug-eluting stent implantation (ARCTIC-Interruption): a randomised trial. | 2014 | Nous avons évalué si la poursuite du DAPT au-delà d'un an après stenting coronarien est bénéfique. | Le critère d'évaluation primaire a été observé chez 27 (4%) patients du groupe d'interruption et 24 (4%) dans le groupe de continuité (hazard ratio [HR] 1 · 17 [95% CI 0 · 68-2 · 03]; p = 0, 58). Les événements hémorragiques majeurs de STEEPLE se sont produits plus souvent dans le groupe de continuité (sept [1%] patients) que dans le groupe d'interruption (un patient [<0, 5%]; HR 0 15 [0, 02-1 20]; = 0, 073). Les saignements majeurs ou mineurs étaient également plus fréquents dans le groupe de continuité que dans le groupe d'interruption (12 [2%] vs 3 [1%] patients, HR 0 26 [0 07-0 91] p = 0 04). | Notre conclusion ne suggère aucun avantage apparent, bien au contraire, à l'extension de DAPT au-delà d'un an après pose d’un stent avec DES quand aucun événement n'a eu lieu dans la première année après le stenting. La concordance entre les résultats de tous les essais d'une telle interruption suggère la nécessité d'une réévaluation des directives pour le DAPT après un stent coronaire vers une durée de traitement plus courte. |
| Short- versus long-term dual antiplatelet therapy after drug-eluting stent implantation: an individual patient data pairwise and network meta-analysis | 2014 | Cette étude a cherché à comparer les résultats cliniques entre les DAPT à court terme (≤6 mois) et à long terme (1 an) et entre 3 mois, 6 mois et 1 an de DAPT post-DES en appairant les données de patients individuels et un réseau de Méta-analyse. | À un an de suivi, il n'y avait pas de différence significative dans le risque de MACE entre les groupes de traitement (HR: 1,11, IC 95%: 0,86 à 1,43, p = 0,44). À l'inverse, le DAPT à court terme a été associé à des taux de saignement significativement plus faibles en 1 an par rapport au DAPT prolongé (HR: 0,66; IC à 95%: 0,46 à 0,94; p = 0,03), avec une tendance à des taux plus faibles de saignements majeurs HR: 0,58; IC 95%: 0,32 à 1,03; p = 0,06). Le nombre d'effets nocifs était de 46 (95% IC: 65 à 32) pour les saignements et 148 pour les saignements majeurs, avec un excès de 21 saignements et 7 saignements majeurs pour 1 000 patients traités avec DAPT à long terme plutôt qu'à court terme. Il n'y avait pas de différence significative entre les taux de MACE dans les groupes à court et à long terme dans la période entre l'interruption DAPT et le suivi d'un an (HR: 1,20; IC 95%: 0,77 à 1,89; p = 0,42). En revanche, le DAPT à court terme était associé à des taux significativement plus faibles de saignements majeurs (HR: 0,30; IC 95%: 0,10 à 0,91; p = 0,03) et d’hémorragies (HR: 0,44; IC 95%: 0,21 à 0,91; = 0,03) par rapport au DAPT prolongé. Aucune différence significative n'a été observée dans les taux de 1 an de MACE entre 3 et 6 mois de DAPT (OR: 0,87, 95% CrI: 0,52 à 1,45), 3 mois et 1 an de DAPT (OR: 1,06; IC 95%: 0,76 à 1,51), ou entre 6 mois et 1 an de DAPT(OR: 1,23; IC 95%: 0,84 à 1,82). En revanche, le DAPT de 6 mois a été associé à des taux de saignements majeurs significativement plus faibles que ceux observés avec le DAPT à 1 an (OR: 0,38; IC à 95%: 0,14 à 0,95). | Comparé au DAPT prolongé, le DAPT à court terme est associé à des taux similaires de MACE, mais des taux de saignement plus faibles après le placement du DES. |
| Optimal duration of dual antiplatelet therapy after drug-eluting stent implantation: a randomized, controlled trial. | 2014 | Étudier les avantages d'une bithérapie (Clopidogrel plus aspirine) par rapport à une monothérapie (aspirine seule) après une bithérapie (Clopidogrel + aspirine) pendant 1 an | Le critère principal était un composite de la mort résultant de causes cardiaques, infarctus du myocarde ou AVC 24 mois après la randomisation. À 24 mois, le critère principal d'évaluation a été observé chez 57 patients traités par l'aspirine seule (2,4%) et 61 patients du groupe thérapeutique Clopidogrel + aspirine (2,6%, hazard ratio 0,94, intervalle de confiance à 95%, 0,66-1,35, p = 0,75). Les 2 groupes ne différaient pas significativement en termes de risques individuels de décès résultant d'une cause quelconque, d'un infarctus du myocarde, d'une thrombose de stent ou d'un AVC. Des saignements majeurs ont été observés respectivement chez 24 patients (1,1%) et 34 (1,4%) dans le groupe traité par l'aspirine et les patients du groupe thérapeutique biologique (hazard ratio, 0,71; intervalle de confiance à 95%: 0,42-1,20; P = 0,20). | Parmi les patients qui ont eu une thérapie antiplaquettaire double de 12 mois sans complications, une thérapie antiplaquettaire double de 24 mois versus une thérapie par aspirine seule n'a pas réduit le risque d'endommagement cardiaque, d'infarctus du myocarde ou d'AVC. |
| Extended duration dual antiplatelet therapy and mortality: a systematic review and meta-analysis | 2014 | Nous avons cherché à évaluer l'effet du traitement antiplaquettaire double de durée prolongée sur la mortalité en effectuant une méta-analyse de tous les essais randomisés et contrôlés de la durée du traitement dans divers troubles cardiovasculaires. | Comparativement à l'aspirine seule ou au traitement antiplaquettaire double de courte durée (≤ 6 mois), le traitement continu n'a pas été associé à une différence de mortalité toutes causes confondues (hasard ratio [HR] 1, 18; p = 0, 17). De même, la mortalité cardiovasculaire (1, 01, 0, 93, 12, p = 0, 81) et la mortalité non cardiovasculaire (1 04, 0 90-1 26, p = 0,66) n’étaient pas différentes pour une thérapie antiplaquettaire double de longue durée ou de courte durée ou avec de l'aspirine seule. | Le traitement antiplaquettaire double de durée prolongée n'a pas été associé à une différence dans le risque de mortalité toutes causes, cardiovasculaires ou non cardiovasculaires par rapport à l'aspirine seule ou au traitement antiplaquettaire double de courte durée. |
| Twelve or 30 Months of Dual Antiplatelet Therapy after Drug-Eluting Stents | 2016 | L'étude bithérapie antiplaquettaire (DAPT) était une étude internationale, randomisé versus placebo conçue pour déterminer les avantages et les risques de la poursuite du traitement double antiplaquettaire au-delà de 1 an après le placement d'un stent coronaire. | Le groupe qui a poursuivi la thiénopyridine, comparativement au groupe recevant le placebo, a une incidence cumulative plus basse de thrombose de stent (0.4% vs. 1.4%; hazard ratio, 0.29 [intervalle de confiance à 95% {CI}, 0,17 à 0,48], P <0,001) ainsi que d’événements cardiovasculaires et cérébrovasculaires majeurs (4,3% vs 5,9%). 1. La thiénopyridine a été associée à une incidence cumulative plus faible d'infarctus du myocarde que le placebo (2,1% vs 4,1%, hazard ratio, 0,47 [IC 95%, 0,37 à 0,61], P <0,001); L’infarctus du myocarde, qui n'était pas lié à la thrombose de l'endoprothèse vasculaire (1,8% vs 2,9%, hazard ratio, 0,59, P <0,001), représentaient 55% des avantages thérapeutiques. 2. Les deux groupes présentaient des taux de mortalité attribuables à des causes cardiaques similaires (0,9% et 1,0% respectivement, P = 0,98), de décès dus à des causes vasculaires (0,1% dans chaque groupe, P = 0,98) et d’AVC (0,8% et 0,9% Respectivement, P = 0,32). 3. Le taux de mortalité de toute cause était de 2,0% avec la thérapie par thiénopyridine et 1,5% avec le placebo (hazard ratio, 1,36 [IC 95%, 1,00 à 1,85], p = 0,05). Points de sécurité : Les taux de saignements modérés ou sévères au cours de la période d'analyse primaire était significativement plus élevé dans le groupe qui a continué de recevoir le traitement thiénopyridine que dans le groupe placebo (2,5% vs 1,6%, risque 1,61 [IC 95%, 1,21 à 2,16] P = 0,001). Mortalité : Au cours de la période d'analyse primaire (du 12ᵉ au 30ᵉ mois), la mortalité toutes causes a été de 2,0% dans le groupe qui a continué à recevoir la thiénopyridine et de 1,5% dans le groupe placebo (hazard ratio, 1,36; P = 0,05). Au cours de la période d'analyse secondaire (de 12 mois à 33 mois), la mortalité toutes causes a été de 2,3% contre 1,8% (hazard ratio, 1,36; P = 0,04). avec un ratio de décès dus à des causes non cardiovasculaires (1,1% vs 0,6%, hazard ratio, 1,80; P = 0,01) comptabilisant la différence de taux entre les deux périodes d'analyse. Parmi les décès dus à des causes non cardiovasculaires, les décès liés à des saignements (11 décès dans le groupe qui a continué à recevoir la thiénopyridine vs 3 décès dans le groupe placebo, P = 0,06) étaient principalement liés à un traumatisme mortel (7 décès vs 2 décès, P = 0,07). Le nombre de décès liés au cancer différait significativement entre les groupes (31 vs 14, P = 0,02) et était porté par des saignements dans le cas de trois patients du groupe thiénopyridine. | La thérapie antiplaquettaire double au-delà d'un an après le placement d'un stent à élution médicamenteuse, comparativement à la thérapie par l'aspirine seule, a considérablement réduit les risques de thrombose de l'endoprothèse vasculaire et d'événements cardiovasculaires et cérébrovasculaires majeurs, mais a été associée à un risque accru de saignement. |
| Three vs twelve months of dual antiplatelet therapy after zotarolimus-eluting stents: the OPTIMIZE randomized trial. | 2013 | Évaluer la non-infériorité clinique de 3 mois (à court terme) vs 12 mois (à long terme) de traitement antiplaquettaire double chez des patients sous intervention coronarienne percutanée (ICP) avec des stents à élution de zotarolimus. | Le NACCE (critère composite comprenant les décès toutes causes, infarctus du myocarde, AVC ou saignements majeurs) s'est produit chez 93 patients recevant un traitement à court terme et 90 patients recevant un traitement à long terme (6,0% vs 5,8% respectivement, différence de risque 0,17 [IC 95%, -1,52 à 1,86], P = 0,002 pour non-infériorité). Les estimations de Kaplan-Meier ont démontré des taux de MACE à 1 an de 8,3% (128) dans le groupe à court terme et de 7,4% (114) dans le groupe à long terme (HR, 1,12 [IC 95%, 0,87-1,45]). Entre 91 et 360 jours, aucune association statistiquement significative n'a été observée pour le NACCE (39 [2,6%] contre 38 [2,6%] pour les groupes à court et à long terme, HR, 1,03 [IC 95%: 0,66-1,60] ), MACE (78 [5,3%] vs 64 [4,3%], HR, 1,22 [IC 95%, 0,88-1,70]), ou stent thrombose (4 [0,3%] vs 1 [0,1%]; IC 95%, 0,44- 35,49]). | Chez les patients atteints d'une maladie coronarienne stable ou d'un SCA à faible risque traités avec des stents à élution de zotarolimus, 3 mois de thérapie antiplaquettaire double étaient non inférieurs à 12 mois pour le NACCE, sans augmenter significativement le risque de thrombose du stent. |
| Duration of Dual Antiplatelet Therapy after Implantation of Drug-Eluting Stents | 2010 | Nous avons évalué l'effet de l'utilisation de la thérapie antiplaquettaire double pendant plus de 12 mois sur les résultats cliniques à long terme chez les patients ayant subi une PCI initiale avec la mise en place d'un stent à élution médicamenteuse. | L'estimation de Kaplan-Meier du taux d'événement pour le critère d'évaluation primaire (infarctus du myocarde ou décès dus à des causes cardiaques) à 2 ans était de 1,8% dans le groupe à double thérapie, contre 1,2% dans le groupe aspirine seul. Il n'y avait pas de différence significative entre les deux groupes de traitement en ce qui concerne le risque de certains points secondaires (infarctus du myocarde, accident vasculaire cérébral, thrombose de l'endoprothèse vasculaire, revascularisation répétée ou décès d'une cause quelconque). Cependant, chez les patients qui avaient reçu une double thérapie antiplaquettaire, comparativement à ceux qui avaient reçu l'aspirine seule, il y avait une augmentation non significative du risque d'infarctus du myocarde, d'accident vasculaire cérébral ou de décès toute cause (1,73 , IC 95%, 0,99 à 3,00, P = 0,051) et du point final composite d'infarctus du myocarde, d'accident vasculaire cérébral ou de décès d'origine cardiaque (hazard ratio 1,84; P = 0,06). Le risque de saignement majeur défini par TIMI était semblable dans les deux groupes. | L'utilisation d'une thérapie antiplaquettaire double pendant une période de plus de 12 mois chez les patients qui avaient reçu des stents à élution médicamenteuse n'était pas significativement plus efficace que l'aspirine en monothérapie pour réduire le taux d'infarctus du myocarde ou la mort de causes cardiaques. |
Conclusion sur la durée de traitement par antiagrégants plaquettaires après une pose de stents actifs :
La HAS et les différents essais cliniques sont unanimes : aucun intérêt de prolonger la thérapie par antiagrégant pour une durée supérieure à 12 mois, les maigres avantages étant compensés par une augmentation de la mortalité par saignements majeurs (hémorragies) ainsi que de la mortalité toute cause et n’étant pas plus efficaces que monothérapie par aspirine seule. Quant à une durée de moins de 12 mois, les essais cliniques ne trouvent quasiment aucune différence entre une durée de traitement de 3 mois, de 6 mois et d’un an…
La durée idéale se situe donc entre 3 mois et 1 an, la différence d’évènements entre ces deux durées étant tout à fait minime et négligeable.
Le Prasugrel et le Ticagrelor sont donc une arnaque…
Hélas oui. Comme on a pu le voir précédemment, aucun avantage concernant ces produits n’a pu être démontré. On peut supposer quand même un certain niveau de conflits d’intérêts (qui a dit corruption…?) pour laisser la sécu rembourser des médicament vendus à un prix 4 à 5 fois supérieur et pas plus efficace que le produit de base (ici le Plavix).
Que penser aussi des cardiologues qui prescrivent massivement l’Efient ou le Brilique ? Soit ils ne lisent pas les essais cliniques, ce qui est inquiétant; soit ils n’en tiennent pas compte, ce qui est tout aussi inquiétant, sinon plus..
- ↑AFU : Stent nu ou actif : quelle différence ?
- ↑Esculape : ASPIRINE – UN MEDICAMENT D’AVENIR ?
- ↑HAS : COMMISSION DE LA TRANSPARENCE
- ↑Haute Autorité de Santé : SYNTHÈSE D’AVIS DE LA COMMISSION DE LA TRANSPARENCE : EFIENT 10 mg (Prasugrel), antiagrégant plaquettaire
- ↑ResearchGate : Prasugrel and Cancer An Uncertain Association or a Credible Risk That Meaningfully Alters the Benefit-Risk Balance
- ↑Haute Autorité de Santé : SYNTHÈSE D’AVIS DE LA COMMISSION DE LA TRANSPARENCE : BRILIQUE 10 mg (ticagrelor), antiagrégant plaquettaire
- ↑Haute Autorité de Santé : COMMISSION DE LA TRANSPARENCE AVIS 19 octobre 2011
- ↑BIP31 : Bulletin d’informations de pharmacologie – décembre 2011 (page 45)
- ↑Haute Autorité de Santé : GUIDE DU PARCOURS DE SOINS Maladie coronarienne stable (page 38)
Dernière modification : 2021-07-15
